(Ciencias de Joseleg) (Biología) (Ecología) (El ecosistema) (Introducción) (Generalidades) (Factores
abióticos) (Productividad) (Ciclos
biogeoquímicos) (Ciclos
biogeoquímicos alterados) (Ingeniero
de ecosistemas) (Servicios
de los ecosistemas) (Interacciones
complejas) (Nicho)
(Referencias
bibliográficas)
Tomado de: (Moon & Moon, 2011).
Durante muchos años, los ecólogos han tratado de comprender
los roles y la importancia de los efectos directos e indirectos en las comunidades.
Los efectos directos, como su nombre lo indica, tratan el impacto directo de un
individuo sobre otro cuando no está mediado o transmitido a través de un tercer
individuo. Los efectos indirectos pueden definirse como el impacto de un
organismo o especie en otro, mediado o transmitido por un tercero. Por ejemplo,
una oruga puede ejercer un efecto directo en una planta al comerla. Si un ave
come esa oruga (también un efecto directo), esto puede reducir el daño a la
planta, lo que resulta en un efecto indirecto del ave en la planta. Nuestra
comprensión de los roles y la importancia relativa de los efectos directos e
indirectos en las comunidades ha cambiado dramáticamente con el tiempo. Los
primeros años de la ecología comunitaria se centraron predominantemente en los
efectos directos. Posteriormente, los efectos indirectos comenzaron a recibir
el mismo tratamiento teórico y empírico. Ahora se acepta ampliamente que tanto
los efectos directos como los indirectos juegan un papel importante en las
comunidades y la atención se ha desplazado hacia la comprensión de los factores
que alteran los tipos y la importancia de estas interacciones. Aquí brindamos
una breve perspectiva histórica sobre los efectos directos e indirectos, y
luego dirigimos nuestra atención a los estudios de casos de que demuestran cómo
los factores abióticos pueden cambiar la importancia de los efectos directos e
indirectos.
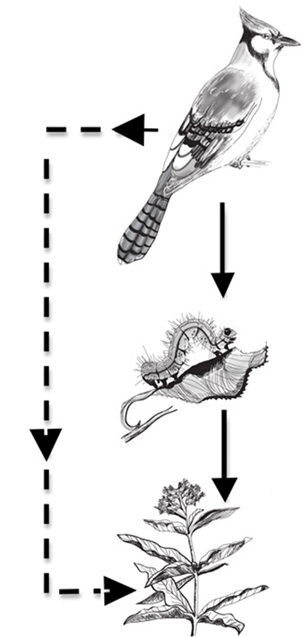
Figura 52. Relaciones indirectas. Un ejemplo de
efectos directos (líneas continuas) y efectos indirectos (líneas discontinuas)
entre tres especies. El depredador (ave) tiene un efecto indirecto positivo en
la especie basal (planta) a través del efecto directo de la depredación en la
oruga, lo que reduce la herbivoría en la planta (también un efecto directo).
Históricamente, los ecólogos centraron su atención en
comprender los efectos directos como la competencia, la herbivoría y la
depredación (por ejemplo, Park 1948, Huffaker 1958, Connell 1961). Se creía que
tales efectos directos eran las fuerzas que conformaban principalmente la
estructura de la población y la comunidad, el núcleo de la selección natural.
Se pensaba que la competencia era particularmente importante ya que las
especies dividían sus nichos, ecológica y evolutivamente, para disminuir el
impacto de la competencia interespecífica (MacArthur 1958, Hutchinson 1959). La
competencia también estuvo a la vanguardia de la ecología experimental, con el
trabajo de ecologistas como Thomas Park (1954) y Joe Connell (1961) que
influyeron significativamente en la forma en que observamos las interacciones
interespecíficas y en cómo estudiamos. Curiosamente, el trabajo de Park sobre
la competencia también ilustró la importancia de los efectos indirectos al
demostrar que el resultado de las interacciones competitivas entre Tribolium castaneum y Tribolium
confusum cambió cuando los escarabajos se infectaron con el parásito Adelina sp. (Park 1948). Los experimentos de Park
también mostraron que el resultado de las interacciones interespecíficas se
puede cambiar por la variación de los factores ambientales abióticos (Park
1954). En general, sin embargo, se pensaba que los efectos indirectos eran
relativamente poco importantes en la configuración de la estructura de la
comunidad (Vandermeer 1969) y recibían poca atención. Debido a su complejidad,
los efectos indirectos pueden ser más difíciles de detectar y cuantificar que
los efectos directos, y esto puede haber contribuido a la subestimación de su
rol en las comunidades (Menge 1995, Strong 1997).
A pesar de la falta de tratamiento experimental y teórico por parte de los ecólogos, la evidencia de que los efectos indirectos pueden ser fuertes e importantes ha estado presente durante muchos años. El uso extensivo del control biológico atestigua la fuerza potencial de los efectos indirectos, ya que el rendimiento de los cultivos se incrementa mediante cascadas tróficas iniciadas por enemigos naturales introducidos o las poblaciones de depredadores y parásitos naturales aumentan. Hairston et al. (1960) en su seminal "mundo verde", el documento llevó este concepto de un entorno agrícola a uno natural al sugerir que el mundo es verde porque los depredadores y parásitos controlan las densidades de los herbívoros, lo que permite que las plantas proliferen (lo que a menudo se conoce como la hipótesis del HSS). De hecho, los estudios sobre cascadas tróficas comenzaron a proliferar y recibieron más tratamiento teórico y empírico que cualquier otra vía de efectos indirectos (revisada en Brett & Goldman 1996, Schmitz et al. 2000, Halaj & Wise 2001). Los estudios que demuestran la importancia de otros efectos indirectos también proliferaron, y quedó claro que los efectos indirectos pueden ser determinantes importantes de la estructura de la comunidad (por ejemplo, Strauss 1991a, b; Wootton 1993, 1994).
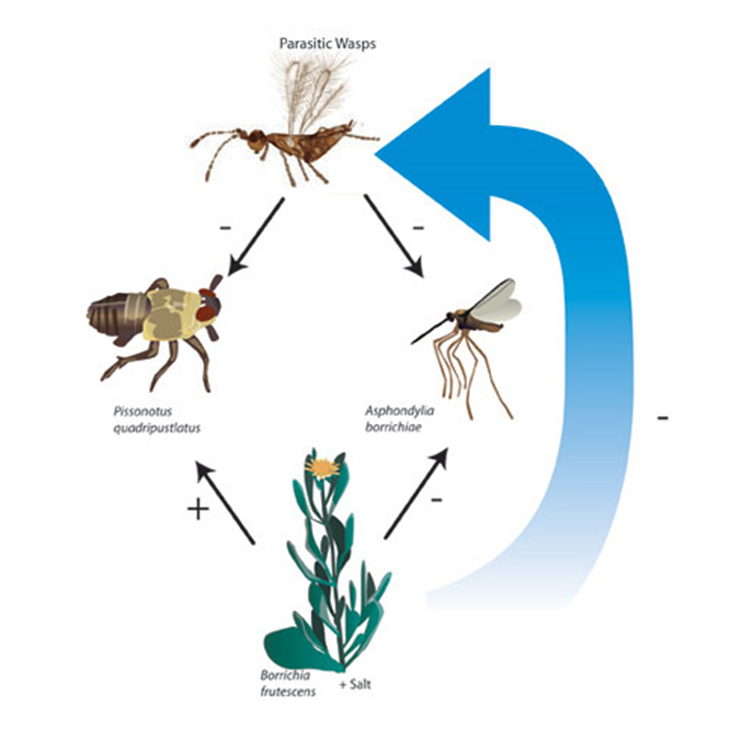
Figura 53. Efectos
indirectos mas fertilizantes. Las principales especies en nuestra
red alimenticia de marismas y algunos de los efectos directos (líneas
continuas) y los efectos indirectos (líneas discontinuas) entre ellos. Esta
figura ilustra las interacciones que ocurren en la comunidad cuando la
disponibilidad de nutrientes aumenta a través de la fertilización. La
fertilización cambia la morfología de la planta, lo que tiene un efecto directo
sobre las avispas parasitoides. Estas avispas tienen un efecto indirecto
positivo en la planta al reducir la densidad de los herbívoros.
Con el entendimiento de que los efectos indirectos pueden
ser importantes, surgió el deseo de comprender las fortalezas relativas de los
efectos directos e indirectos en los ecosistemas naturales. En una revisión de
estudios experimentales, Schoener (1993) informó que solo alrededor de una
cuarta parte de todos los cambios en la comunidad informados se debían a
efectos indirectos, mientras que el resto se debía a efectos directos. Esta
revisión parecía apoyar la opinión anterior de que, en relación con los efectos
directos, los efectos indirectos no eran muy importantes. Sin embargo, Menge
(1995) informó que, en promedio, 40 a 45% de todos los cambios en la comunidad
se debieron a efectos indirectos y que, en estudios individuales, el porcentaje
podría ser tan alto como 65%. Por lo tanto, parecía que los roles relativos de
estos factores variaban entre los estudios y que, en ciertas circunstancias,
los efectos indirectos podían ser tan fuertes como los efectos directos.
La comprensión de los factores que cambian la importancia
relativa de los efectos directos e indirectos sigue siendo un punto focal de
los estudios de las interacciones de las especies. Fretwell y Oksanen y sus
colegas (Fretwell 1977, Oksanen et al. 1981) aplicaron este concepto al modelo
HSS anterior. Oksanen et al., sugirió que el escenario propuesto por Hairston
et al., era una posibilidad, pero los efectos indirectos de los enemigos
naturales en las plantas no siempre eran fuertes. Sugirieron que la
productividad del ecosistema determinaba las fortalezas relativas de varios
efectos directos e indirectos entre las especies. Por ejemplo, en ecosistemas
con una productividad muy baja, las plantas estarían limitadas por la
competencia por los recursos y no producirían suficiente biomasa para apoyar a
los herbívoros. A medida que aumentaba la productividad, las poblaciones de
herbívoros podían ser apoyadas y las poblaciones de plantas ahora serían
limitadas por la herbivoría. Con mayores incrementos en la productividad, los
enemigos naturales ahora podrían ser apoyados y limitarían el tamaño de las
poblaciones de herbívoros, lo que resultaría en un efecto indirecto positivo en
las plantas. Si la productividad es suficiente para soportar un cuarto nivel
trófico, estos enemigos secundarios tendrían un efecto indirecto positivo sobre
los herbívoros y un efecto indirecto negativo sobre las plantas. Menge y
Sutherland (1976) describieron cómo escenarios similares podrían desarrollarse
con diferentes niveles de estrés ambiental.
Las hipótesis de HSS, Oksanen-Fretwell y Menge-Sutherland no
solo abordaron el tema de la importancia relativa de los efectos directos e
indirectos en las comunidades, sino que también provocaron un debate asociado
con respecto a la importancia de los factores de arriba hacia abajo y de abajo
hacia arriba. Hunter y Price (1992) establecieron un marco teórico en el que
los factores ambientales establecen el escenario en el que actúan las
interacciones interespecíficas. Su modelo integró efectos directos e indirectos,
factores de arriba hacia abajo y de abajo hacia arriba, y heterogeneidad
ambiental y estableció el paradigma para muchos estudios futuros, algunos de
los cuales se analizan a continuación.
Las marismas saladas ofrecen excelentes oportunidades para
examinar los efectos de la heterogeneidad ambiental en las interacciones
directas e indirectas. Las marismas saladas son variables espacial y
temporalmente en una serie de factores abióticos, incluidos los niveles de
nutrientes, que pueden impulsar la productividad y la salinidad, que puede
causar estrés
en las plantas (Adam 1990). Además, las comunidades en las
marismas salinas tienden a ser más simples que en muchos otros hábitats, lo que
facilita el esclarecimiento de las vías de interacción directa e indirecta, y
hace que la manipulación experimental de estas vías y especies en el campo sea
logísticamente factible (Denno et al. 2002, Moon & Stiling 2004). El
estudio de las interacciones interespecíficas en la marisma ha permitido
realizar pruebas explícitas de muchas de las ideas propuestas en los modelos
HSS, Oksanen-Fretwell, Menge-Sutherland y Hunter & Price y ha revelado cómo
considerar los efectos tanto directos como indirectos en el contexto de la
heterogeneidad ambiental es esencial para entender la dinámica de la comunidad.
Muchos estudios se han centrado en la comunidad de
artrópodos asociada con la margarita de ojo de mar, Borrichia
frutescens
Figura 54. Efectos indirectos menos fertilizantes. Las
interacciones que se producen en la comunidad cuando el estrés ambiental
aumenta a través de la adición de sal. Las principales especies en nuestra red
alimenticia de marismas y algunos de los efectos directos (líneas continuas) y
los efectos indirectos (líneas discontinuas) entre ellos. Las plantas
estresadas por la sal se vuelven más duras y más leñosas, lo que reduce el
parasitismo de las avispas. Las avispas tienen menos efecto sobre los
herbívoros y no se observan efectos indirectos sobre las plantas.
Muchos estudios han demostrado que las densidades de
insectos herbívoros están relacionadas con la disponibilidad de nutrientes (por
ejemplo, Mattson 1980, Dixon 1985, Waring & Cobb 1992). Se ha demostrado
que esto también es cierto para los herbívoros de B.
frutescens. Una serie de experimentos de campo mostraron que el aumento
de la disponibilidad de nitrógeno mediante la fertilización de las plantas en
el campo, dio lugar a efectos directos positivos sobre las densidades del
homóptero Pissonotus quadripustulatus, que se
alimenta del floema, la mosca del asfalto Asphondylia
borrichiae, y la lepidóptera
Los cambios en los niveles de salinidad del suelo también alteran la calidad y la morfología de la planta, lo que resulta en efectos directos sobre los herbívoros. En el caso de la salinidad, a diferencia del nitrógeno, los efectos variaron entre las especies de herbívoros. El aumento de los niveles de salinidad del agua en los poros del suelo mediante la adición experimental de sal dio lugar a densidades más altas de P. quadripustulatus (Moon & Stiling 2000), pero también a densidades más bajas de A. borrichiae “Figura 54” (Moon & Stiling 2002a). Para el fulgoromorfo P. quadripustulatus, el aumento puede haber resultado de la movilización de aminoácidos para lograr un equilibrio osmótico más favorable (Cavalieri y Huang 1979, White 1984). En contraste, en A. borrichiae puede haber sido afectada por un menor contenido de humedad y un endurecimiento de los tejidos de la planta que se produce en entornos más salinos (Moon & Stiling 2002a).
Figura 55. Efecto del
fertilizante en el fenotipo de una especie clave. Un tallo verde
de Borrichia frutescens a la izquierda y un tallo leñoso a la derecha.
Los tallos verdes son más suaves y más fáciles para que penetren las avispas
parasitoides que los tallos leñosos, lo que produce diferentes niveles de
parasitismo de los huevos y larvas de herbívoros dentro de estos dos tipos de
tallos.
Además de tener efectos directos sobre los herbívoros, los cambios en la calidad de las plantas y la morfología inducida por factores abióticos afectaron a los enemigos naturales y, a su vez, afectaron a los herbívoros y las plantas (Figura 53 y Figura 54). En las marismas saladas de Florida, los principales enemigos naturales de los herbívoros en B. frutescens son las avispas parásitas. Para atacar a sus huéspedes, las avispas hembras deben perforar la epidermis de la planta para acceder al huevo o larva del huésped que vive dentro de la planta. Los cambios en los niveles de salinidad y nutrientes afectan la morfología de los tallos de B. frutescens. En ambientes benignos, con bajos niveles de estrés y alta disponibilidad de nutrientes, los tallos de B. frutescens crecen rápidamente y tienen una suave epidermis verde. En ambientes más estresantes (mayor salinidad y / o menor disponibilidad de nutrientes), el crecimiento de la planta disminuye y la epidermis de la planta adquiere una textura dura y leñosa que es físicamente más difícil de penetrar (Figura 54).
Figura 56. Fulgoromorfos y fertilizantes.
Número medio (± 1 SEM) de fulgoromorfos Pissonotus quadripustulatus por
cada 20 Borrichia frutescens proviene de parcelas que no recibieron
tratamiento (control), fertilizantes nitrogenados (verde), trampas que
redujeron el parasitismo (amarillo), o fertilizantes y trampas (azul). El
fertilizante produce tallos más suaves y verdes en las parcelas a lo largo del
año, y esto causa diferencias en los efectos de los tratamientos entre la
primavera y el otoño. Por ejemplo, el fertilizante (línea verde) tiene un
fuerte efecto positivo en los planeadores en la primavera, pero un efecto menor
en el otoño debido a que la mayor parte de los tallos verdes suaves dan lugar a
un mayor parasitismo de los planteros en estas parcelas más adelante en el estudio.
La Figura 56
muestra los resultados de un estudio en el que se fertilizaron parcelas de Borrichia de 1m2, se redujeron las
trampas parásitas con trampas o se recibieron ambos tratamientos (fertilizante
y trampas). Con el tiempo, en las parcelas fertilizadas, la frecuencia de los
tallos verdes suaves, que los parasitoides pueden penetrar más fácilmente,
aumenta y esto aumenta el parasitismo de los huevos de fulgoromorfos. Esto
resulta en una disminución del efecto del fertilizante en la densidad del
fulgoromorfo (compare la línea de fertilizante verde con la línea de control
negra en la Figura 56)
porque algunos de los efectos directos positivos del nitrógeno en la densidad fulgoromorfo
se compensan con este aumento en el parasitismo. Con el tiempo, también hay un
aumento en la densidad fulgoromorfo en parcelas fertilizadas donde el
parasitismo se redujo experimentalmente atrapando avispas (compare la línea
azul de fertilizantes y trampas con las otras en la Figura 56.
Al realizar un experimento de prensa (Bender et al. 1984) y
al analizar las densidades del fulgoromorfo a lo largo del tiempo, se puede ver
el efecto indirecto retardado de la morfología de la planta sobre la densidad del
fulgoromorfo (por ejemplo, comparar los efectos del tratamiento en mayo v.
Octubre en la Figura 56).
En áreas que son más salinas, los tallos de Borrichia
Sin embargo, la historia no termina ahí, ya que la
competencia entre herbívoros puede interactuar con y suprimir los efectos
directos e indirectos inducidos abióticamente de las plantas huésped y los
enemigos naturales. Las orugas de la polilla Argyresthia
Figura 56. Efectos
de cambio de fenotipo y densidad poblacional del parásito. Número promedio (± 1
SEM) del fulgoromorfo Pissonotus quadripustulatus por 20 Borrichia
frutescens proviene de parcelas que no recibieron tratamiento (control),
sal para aumentar la salinidad del suelo, trampas que redujeron el parasitismo,
o sal y trampas. Los datos se recolectaron de parches de pantanos que tenían
(a) densidades bajas de larvas de polillas que perforan el tallo, o (b)
densidades altas de estas larvas, que son competidores de los fulgoromorfos.
Hay efectos significativos de los tratamientos en el panel a (baja
competencia), pero no en el panel b (alta competencia).
Según lo sugerido por modelos teóricos como los de Oksanen
et al. (1981), Menge y Sutherland (1976) y Hunter y Price (1992), la
heterogeneidad abiótica en la marisma puede afectar la importancia relativa de
las interacciones directas e indirectas de arriba hacia abajo y de abajo hacia
arriba. Alberti et al. (2010) mostró efectos fuertes similares del ambiente
abiótico en las interacciones tróficas en una marisma salada en Argentina. Las
marismas saladas no son los únicos ecosistemas en los que encontramos efectos
directos e indirectos mediados abióticamente. Están muy extendidos en
ecosistemas que van desde el Mar de Barents en el Océano Ártico (Ciannelli et
al. 2007) hasta el Serengeti de África (Sinclair et al. 2007). Comprender cómo
los factores abióticos median las interacciones directas e indirectas no solo
es importante en teoría, sino también en la práctica. La modificación
antropogénica del ambiente abiótico a través de la contaminación, la
eutrofización y el cambio climático global continúa aumentando. Comprender y
predecir el impacto de estos efectos antropogénicos en las interacciones entre
las especies será uno de los desafíos más importantes a los que se enfrentarán
los ecólogos comunitarios en el futuro.





No hay comentarios:
Publicar un comentario