(Ciencias de Joseleg) (Biología) (Ecología) (Los ecosistemas acuáticos) (Introducción) (Generalidades) (Ríos) (Lagos y
lagunas) (Humedales) (Estuarios) (Océano
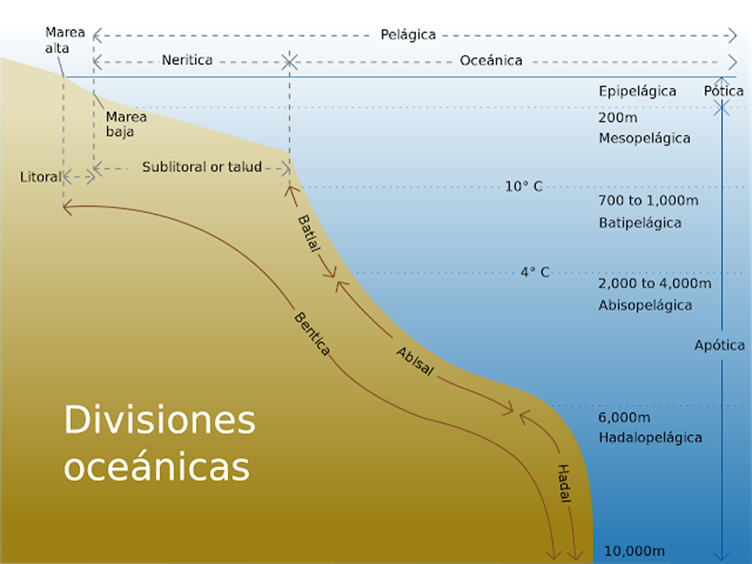
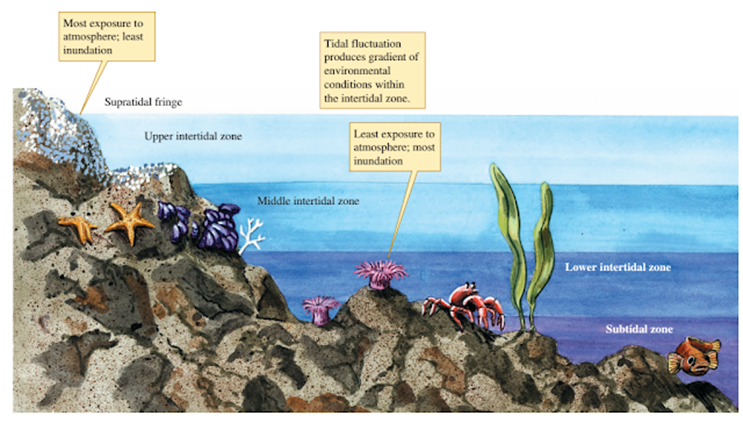
intermareas) (Océano
abierto y abismos) (Arrecifes,
kelps y pastos) (Referencias
bibliográficas)
Baccini, P., & Lerman, A. (2013). Lakes: chemistry, geology, physics. Springer Science & Business Media.
Barbiero,
R. P., & Tuchman, M. L. (2004). Long-term dreissenid impacts on water
clarity in Lake Erie. Journal of Great Lakes Research, 30(4),
557–565.
Belk, C.,
& Maier, V. B. (2013). Biology Science for Life with physiology.
(Pearson, Ed.) (4th ed.).
Board, M.
E. A. (2005). Ecosystems and Human Well-Being: Wetlands and Water Synthesis.
Bowes, M.
J., Ings, N. L., McCall, S. J., Warwick, A., Barrett, C., Wickham, H. D., …
Roberts, C. (2012). Nutrient and light limitation of periphyton in the River
Thames: Implications for catchment management. Science of the Total
Environment, 434, 201–212.
Brittain,
J. E., & Milner, A. M. (2001). Ecology of glacier‐fed rivers: current
status and concepts. Freshwater Biology, 46(12), 1571–1578.
Brookes, A.
(1995). Challenges and objectives for geomorphology in UK river management. Earth
Surface Processes and Landforms, 20(7), 593–610.
Bunn, S.
E., & Arthington, A. H. (2002). Basic principles and ecological
consequences of altered flow regimes for aquatic biodiversity. Environmental
Management, 30(4), 492–507.
Cole, G.
A., & Weihe, P. E. (2015). Textbook of limnology. Waveland Press.
Conroy, J.
D., Edwards, W. J., Pontius, R. A., Kane, D. D., Zhang, H., Shea, J. F., …
Culver, D. A. (2005). Soluble nitrogen and phosphorus excretion of exotic
freshwater mussels (Dreissena spp.): potential impacts for nutrient
remineralisation in western Lake Erie. Freshwater Biology, 50(7),
1146–1162.
Contreras-B,
S., & Lozano-V, M. L. (1994). Water, endangered fishes, and development
perspectives in arid lands of Mexico. Conservation Biology, 8(2),
379–387.
Cooke, G.
D., Welch, E. B., Peterson, S., & Nichols, S. A. (2016). Restoration and
management of lakes and reservoirs. CRC press.
Cronk, J.
K., & Fennessy, M. S. (2016). Wetland plants: biology and ecology.
CRC press.
Darby, S.,
& Sear, D. (2008). River restoration: managing the uncertainty in restoring
physical habitat. John Wiley & Sons.
Darwin, C.
(1842). On the Structure and Distribution of Coral Reefs: Being the First Part
of the Geology of the Voyage of the Beagle Under the Command of Captain
Fitzroy, RN During the Years 1832 to 1836. Smith, Elder.
Davies, B.
R., & Walker, K. F. (2013). The ecology of river systems (Vol. 60).
Springer Science & Business Media.
Delong, M.
D., & Thoms, M. C. (2016). An ecosystem framework for river science and
management. River Science: Research and Management for the 21st Century,
11–36.
Dudgeon,
D., Arthington, A. H., Gessner, M. O., Kawabata, Z., Knowler, D. J., Lévêque,
C., … Stiassny, M. L. J. (2006). Freshwater biodiversity: importance, threats,
status and conservation challenges. Biological Reviews, 81(2),
163–182.
Egerton, F.
N. (2014). History of ecological sciences, part 50: Formalizing limnology,
1870s to 1920s. The Bulletin of the Ecological Society of America, 95(2),
131–153.
Elderfield,
H. (1998). SCHLESINGER, WH 1997. Biogeochemistry. An Analysis of Global Change,
xiii+ 588 pp. San Diego, London, Boston, New York, Sydney, Tokyo, Toronto:
Academic Press. Price US $49.95 (paperback). ISBN 0 12 625155 X. CHAMEIDES, WL
& PERDUE, EM 1997. Biogeochemica. Geological Magazine, 135(06),
819–842.
Ellison, A.
M. (2004). Wetlands of central America. Wetlands Ecology and Management,
12(1), 3–55.
Elster,
H.-J. (1974). History of limnology. Mitteilungen Der Internationalen
Vereinigung Für Theoretische Und Angewandte Limnologie.
Farber, S.
C., Costanza, R., & Wilson, M. A. (2002). Economic and ecological concepts
for valuing ecosystem services. Ecological Economics, 41(3),
375–392.
Fernández,
D., Barquín, J., & Raven, P. (2011). A review of river habitat
characterisation methods: indices vs. characterisation protocols. Limnetica,
30(2), 217–234.
Forel, F.
A. (1892). Le Léman: monographie limnologique (Vol. 1). F. Rouge.
Fraser, L.
H., & Keddy, P. A. (2005). The world’s largest wetlands: ecology and
conservation. Cambridge University Press.
Fu, G.,
Chen, S., Liu, C., & Shepard, D. (2004). Hydro-climatic trends of the
Yellow River basin for the last 50 years. Climatic Change, 65(1),
149–178.
Giller, P.
S., & Malmqvist, B. (1998). The biology of streams and rivers.
Oxford University Press.
Greb, S.
F., DiMichele, W. A., & Gastaldo, R. A. (2006). Evolution and importance of
wetlands in earth history. Geological Society of America Special Papers,
399, 1–40.
Hamer, A.
J., & McDonnell, M. J. (2008). Amphibian ecology and conservation in the
urbanising world: a review. Biological Conservation, 141(10),
2432–2449.
Haygarth,
P. M., Jarvie, H. P., Powers, S. M., Sharpley, A. N., Elser, J. J., Shen, J., …
Burt, T. (2014). Sustainable phosphorus management and the need for a long-term
perspective: The legacy hypothesis. ACS Publications.
Hebert, P.
D. N., Muncaster, B. W., & Mackie, G. L. (1989). Ecological and genetic
studies on Dreissena polymorpha (Pallas): a new mollusc in the Great Lakes. Canadian
Journal of Fisheries and Aquatic Sciences, 46(9), 1587–1591.
Hoefnagels,
M. (2015). Biology: concepts and investigations (3rd ed.). McGraw-Hill
New York.
Houlahan,
J. E., & Findlay, C. S. (2003). The effects of adjacent land use on wetland
amphibian species richness and community composition. Canadian Journal of
Fisheries and Aquatic Sciences, 60(9), 1078–1094.
Humphries,
P., Keckeis, H., & Finlayson, B. (2014). The river wave concept:
integrating river ecosystem models. BioScience, biu130.
Hurlimann,
A., Wilson, E., & Keele, S. (2017). Framing Sustainable Urban Water
Management: A Critical Analysis of Theory and Practice. In Urban Water
Trajectories (pp. 53–68). Springer.
Irwin, L.,
Irwin, K., Gardner, S. C., & Oberdórster, E. (2006). Global threats
affecting the status of reptile populations. Toxicology of Reptiles.
Jiang, S.,
Ren, L., Yong, B., Singh, V. P., Yang, X., & Yuan, F. (2011). Quantifying
the effects of climate variability and human activities on runoff from the
Laohahe basin in northern China using three different methods. Hydrological
Processes, 25(16), 2492–2505.
Jiggins, C.
D. (2014). Evolutionary biology: radiating genomes. Nature, 513(7518),
318–319.
Johnson, B.
L., Richardson, W. B., & Naimo, T. J. (1995). Past, present, and future
concepts in large river ecology. BioScience, 45(3), 134–141.
Jude, D.
J., & Pappas, J. (1992). Fish utilization of Great Lakes coastal wetlands. Journal
of Great Lakes Research, 18(4), 651–672.
Karatayev,
A. Y., Burlakova, L. E., Pennuto, C., Ciborowski, J., Karatayev, V. A., Juette,
P., & Clapsadl, M. (2014). Twenty five years of changes in Dreissena spp.
populations in Lake Erie. Journal of Great Lakes Research, 40(3),
550–559.
Karr, J.
R., & Chu, E. W. (2000). Introduction: Sustaining living rivers. In Assessing
the Ecological Integrity of Running Waters (pp. 1–14). Springer.
Keddy, P.
A. (2010). Wetland ecology: principles and conservation. Cambridge
University Press.
Keddy, P.
A., Fraser, L. H., Solomeshch, A. I., Junk, W. J., Campbell, D. R., Arroyo, M.
T. K., & Alho, C. J. R. (2009). Wet and wonderful: the world’s largest
wetlands are conservation priorities. Bioscience, 59(1), 39–51.
Kingsford,
R. T. (2000). Ecological impacts of dams, water diversions and river management
on floodplain wetlands in Australia. Austral Ecology, 25(2),
109–127.
Kirk, G.
(2004). The biogeochemistry of submerged soils. John Wiley & Sons.
Koblmüller,
S., Albertson, R. C., Genner, M. J., Sefc, K. M., & Takahashi, T. (2015).
Preface: Advances in cichlid research: behavior, ecology, and evolutionary
biology. Hydrobiologia, 748(1), 1–5.
Kornfield,
I., & Smith, P. F. (2000). African cichlid fishes: model systems for
evolutionary biology. Annual Review of Ecology and Systematics, 31(1),
163–196.
Lehtinen,
R. M., & Galatowitsch, S. M. (2001). Colonization of restored wetlands by
amphibians in Minnesota. The American Midland Naturalist, 145(2),
388–396.
Mackean, D.
G., & Hayward, D. (2014). Biology (3rd ed.). IGCSE Cambridge.
Mader, S.
S. (2010). Biology (10th ed.). McGraw-Hill Education.
Mader, S.
S., & Windelspecht, M. (2015). Biology (12th ed.). McGraw-Hill
Education.
Mader, S.
S., & Windelspecht, M. (2018). Essentials of biology (5th ed.).
McGraw-Hill Education.
Maltby, E.
(2009). Functional assessment of wetlands: towards evaluation of ecosystem
services. Elsevier.
Maltby, E.,
& Acreman, M. C. (2011). Ecosystem services of wetlands: pathfinder for a
new paradigm. Hydrological Sciences Journal, 56(8), 1341–1359.
Mason, K.
A., Losos, J. B., Singer, S. R., & Raven, P. H. (2014). Biology (7th
ed.). McGraw-Hill New York.
McLachlan,
A., & Dorvlo, A. (2005). Global patterns in sandy beach macrobenthic
communities. Journal of Coastal Research, 21(4), 674–687.
McMenamin,
S. K., Hadly, E. A., & Wright, C. K. (2008). Climatic change and wetland
desiccation cause amphibian decline in Yellowstone National Park. Proceedings
of the National Academy of Sciences, 105(44), 16988–16993.
Miller, G.
T., & Spoolman, S. E. (2009). Essentials of Ecology (5th ed.).
Brooks/Cole.
Minh, L.
Q., Tuong, T. P., Van Mensvoort, M. E. F., & Bouma, J. (1998). Soil and
water table management effects on aluminum dynamics in an acid sulphate soil in
Vietnam. Agriculture, Ecosystems & Environment, 68(3),
255–262.
Mittelbach,
G. G. (2012). Community ecology. Sinauer Associates Sunderland, MA.
Molles, M.
C. J. (2013). Ecology: concepts and applications (7th ed.). New York:
McGraw-Hill New York.
Moore, A.,
& Reddy, K. R. (1994). Role of Eh and pH on phosphorus geochemistry in
sediments of Lake Okeechobee, Florida. Journal of Environmental Quality,
23(5), 955–964.
Morritt,
D., Stefanoudis, P. V, Pearce, D., Crimmen, O. A., & Clark, P. F. (2014).
Plastic in the Thames: a river runs through it. Marine Pollution Bulletin,
78(1), 196–200.
Natesan,
S., & Strayer, D. L. (2016). Long-term increases in shell thickness of
zebra mussels (Dreissena polymorpha) in the Hudson River. Fundamental and
Applied Limnology/Archiv Für Hydrobiologie, 188(3), 245–248.
Nilsson,
C., & Berggren, K. (2000). Alterations of Riparian Ecosystems Caused by
River Regulation: Dam operations have caused global-scale ecological changes in
riparian ecosystems. How to protect river environments and human needs of
rivers remains one of the most important questions of ou. BioScience, 50(9),
783–792.
Oglesby, R.
T., Carlson, C. A., & McCann, J. A. (2013). River Ecology and Man:
Proceedings of an International Symposium on River Ecology and the Impact of
Man, Held at the University of Massachusetts, Amherst, Massachusetts, June
20-23, 1971. Elsevier.
Olima, W.
H. A., Hayombe, P. O., & Nyamweno, I. M. (2015). University, County
Government and Community Partnership for Wetland Conservation and Ecotourism
Development on the Shores of Lake Victoria, Kenya. In Implementing Campus
Greening Initiatives (pp. 151–164). Springer.
Olson, J.
(2016). Dispersal of Zebra Mussels, Dreissena polymorpha, Downstream of an
Invaded Reservoir. Texas State University.
Poff, N.
L., Brown, C. M., Grantham, T. E., Matthews, J. H., Palmer, M. A., Spence, C.
M., … Dominique, K. C. (2015). Sustainable water management under future
uncertainty with eco-engineering decision scaling. Nature Climate Change.
Pringle, C.
M., Freeman, M. C., & Freeman, B. J. (2000). Regional Effects of Hydrologic
Alterations on Riverine Macrobiota in the New World: Tropical–Temperate
Comparisons: The massive scope of large dams and other hydrologic modifications
in the temperate New World has resulted in distinct regional trends of b. BioScience,
50(9), 807–823.
Rana, S. V.
S. (2013). Essentials of ecology and environmental science. PHI Learning
Pvt. Ltd.
Reece, J.
B., Urry, L. A., Wasserman, S. A., Cain, M. L., Minorsky, P. V, & Jackson,
R. B. (2014). Campbell Biology (10th ed.). Pearson Higher Ed.
Ricciardi,
A., & Whoriskey, F. G. (2004). Exotic species replacement: shifting
dominance of dreissenid mussels in the Soulanges Canal, upper St. Lawrence
River, Canada. Journal of the North American Benthological Society, 23(3),
507–514.
Richter, B.
D., Baumgartner, J. V, Powell, J., & Braun, D. P. (1996). A method for
assessing hydrologic alteration within ecosystems. Conservation Biology,
10(4), 1163–1174.
Rijssel, J.
C., Hoogwater, E. S., Kishe‐Machumu, M. A., Reenen, E. van, Spits, K. V,
Stelt, R. C., … Witte, F. (2015). Fast adaptive responses in the oral jaw of
Lake Victoria cichlids. Evolution, 69(1), 179–189.
Roe, J. H.,
Kingsbury, B. A., & Herbert, N. R. (2003). Wetland and upland use patterns
in semi-aquatic snakes: implications for wetland conservation. Wetlands,
23(4), 1003–1014.
Sadava, D.,
Berenbaum, M., & Hillis, D. (2014). Life the Science of Biology
(10th ed.). Sinauer & MacMillian.
Serena, M.
(1994). Use of time and space by platypus (Ornithorhynchus anatinus:
Monotremata) along a Victorian stream. Journal of Zoology, 232(1),
117–131.
Service, U.
S. F. and W., & Cowardin, L. M. (1979). Classification of wetlands and
deepwater habitats of the United States. Fish and Wildlife Service, US
Department of the Interior Washington, DC.
Simon, E.,
Reece, J., & Dickey, J. (2013). Essential biology with physiology
(4th ed.). Pearson.
Solomon,
E., Martin, C., Martin, D. W., & Berg, L. R. (2014). Biology (10th
ed.). Cengage Learning.
Sparks-Jackson,
B. L. (2015). Ecological units and spatial pattern in river ecosystems.
University of Michigan.
Stannard,
H. J., Wolfenden, J., & Old, J. M. (2010). Evaluating the capacity of
constructed wetlands to sustain a captive population of Platypus
(Ornithorhynchus anatinus). Australasian Journal of Environmental Management,
17(1), 27–34.
Starr, C.,
Evers, C., & Starr, L. (2013). Biology: Today and Tomorrow With
Physiology (4th ed.). Brooks/Cole.
Statzner,
B., & Higler, B. (1985). Questions and comments on the river continuum
concept. Canadian Journal of Fisheries and Aquatic Sciences, 42(5),
1038–1044.
Straskraba,
M., Tundisi, J. G., & Duncan, A. (2013). Comparative reservoir limnology
and water quality management (Vol. 77). Springer Science & Business
Media.
Thoms, M.
C., Delong, M. D., Flotemersch, J. E., & Collins, S. E. (2017). Physical
heterogeneity and aquatic community function in river networks: A case study
from the Kanawha River Basin, USA. Geomorphology, 290, 277–287.
Thorp, J.
H. (2014). Metamorphosis in river ecology: from reaches to macrosystems. Freshwater
Biology, 59(1), 200–210.
Tuong, T.
P. (n.d.). Soil and water table management effects on aluminum dynamics in an
acid sulphate soil in Vietnam.--p. 255-262. En: Agriculture Ecosystems and
Environment (Netherlands).--Vol. 68, no 3 (Apr 1998).
van
Rijssel, J. C., Hecky, R. E., Kishe-Machumu, M. A., & Witte, F. (2016).
Changing ecology of Lake Victoria cichlids and their environment: evidence from
C13 and N15 analyses. Hydrobiologia, 1–17.
Vannote, R.
L., Minshall, G. W., Cummins, K. W., Sedell, J. R., & Cushing, C. E.
(1980). The river continuum concept. Canadian Journal of Fisheries and
Aquatic Sciences, 37(1), 130–137.
Verones,
F., Saner, D., Pfister, S., Baisero, D., Rondinini, C., & Hellweg, S.
(2013). Effects of consumptive water use on biodiversity in wetlands of
international importance. Environmental Science & Technology, 47(21),
12248–12257.
Ward, J. V,
& Tockner, K. (2001). Biodiversity: towards a unifying theme for river
ecology. Freshwater Biology, 46(6), 807–820.
Whittaker,
R. H., & Likens, G. E. (1973). Primary production: the biosphere and man. Human
Ecology, 1(4), 357–369.
Williams,
J. D., & Dodd Jr, C. K. (1979). Importance of wetlands to endangered and
threatened species. Wetland Functions and Values: The State of Our
Understanding. American Water Resources Association, Minneapolis, Minnesota,
USA, 565–575.
Zehr, K.
(2015). The Effects of Rainfall Runoff on Suburban Wetland Water Quality.
Zhu, J.-Q.,
Yu, H., & He, Q.-Y. (2013). Development of wetland agriculture and its
prospect. In Intelligent System Design and Engineering Applications (ISDEA),
2013 Third International Conference on (pp. 596–601). IEEE.